Por que a água não é produzida em massa se conhecemos a sua fórmula molecular?
A crise da água nos obriga a trabalhar em novas tecnologias para a reutilização do recurso mais precioso para a vida. Mas talvez tenha pensado: porque não a criamos do zero nos laboratórios, se já sabemos que H2O é a sua "receita"?

Sabemos da existência de vários métodos físicos e químicos de captação, dessalinização, purificação, potabilização e redistribuição da água para reutilizar este recurso vital. Embora as tecnologias estejam avançando neste ramo, com métodos melhorados e mais eficientes, ainda não é o suficiente e a crise da água continua se agravando.
Da união de dois átomos de hidrogênio (H) e um de oxigênio (O) obtém-se: H2O (monóxido de di-hidrogênio), que é a fórmula molecular da água. Temos os ingredientes disponíveis mas, obviamente, alguns dos passos desta "receita" não devem ser simples de se fazer em laboratório, e há razões para não ser possível criar água em massa.
É possível fabricar água?
Sim, o processo de "fazer" água a partir do zero é possível, mas há uma (ou duas) razões fundamentais para que isso não seja feito em grande escala. É por isso que a ciência está continuamente à procura de alternativas tecnológicas para conseguir o melhor método de reutilização da água: porque não somos capazes de criar fontes inesgotáveis de "água artificial nova" em grande escala, e muito menos de instalá-las em pontos estratégicos do planeta para acabar com a crise da água. Aqui lhe dizemos porque a água não pode ser criada a partir do zero.
Criação de água: eletrólise e fotólise
A água em laboratório pode ser obtida através de dois processos principais: a eletrólise e a fotólise.
A eletrólise é o processo pelo qual a água é dividida nos seus componentes básicos, o oxigênio e o hidrogênio, através da aplicação de uma corrente elétrica. O oxigênio é liberado em um elétrodo e o hidrogênio em outro. Estes dois gases podem então ser coletados e recombinados para formar água novamente. Este processo é utilizado em algumas aplicações industriais, como a produção de hidrogênio para combustível.

A fotólise, por outro lado, envolve a separação da água nos seus componentes básicos através da exposição à luz. Isto é feito através da utilização de um fotocatalisador, que é um material que absorve a luz e catalisa a reação química. O oxigênio e o hidrogênio podem então ser coletados da mesma forma que na eletrólise.
Ambos os métodos de criação requerem enormes quantidades de energia, tornando o processo ineficiente e extremamente perigoso. No entanto, estes processos são essenciais em algumas aplicações industriais e podem ter implicações importantes na pesquisa de tecnologias verdes e na produção de combustíveis limpos.
Avanços na produção de água
Há anos que os cientistas trabalham para encontrar formas de criar água, e um grupo do Departamento de Química da Universidade de Illinois, nos EUA, publicou em 2007 uma nova forma de produzir água sem uma grande explosão. No entanto, este processo continua sendo muito custoso e ineficaz, mas pode ser utilizado para outro objetivo importante.
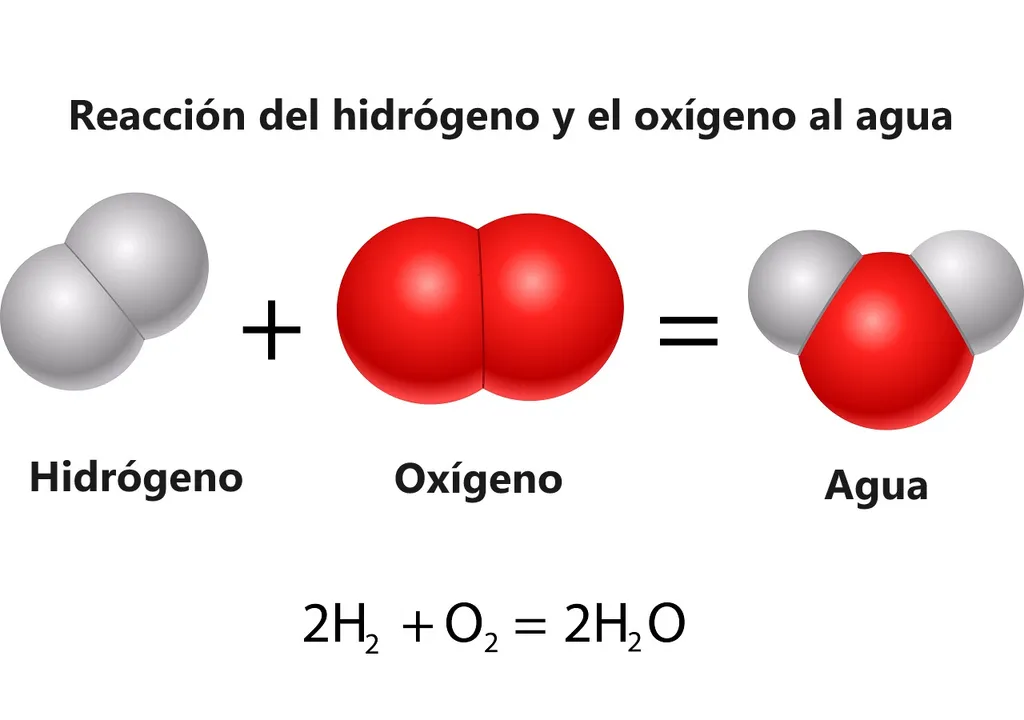
"A reação (2H2 + O2 = 2H2O + Energia) é conhecida há séculos, mas até agora ninguém a tinha feito funcionar em uma solução homogênea", afirmou Thomas Rauchfuss, professor de química da Universidade e autor principal do estudo.
A conhecida reação também descreve o que acontece no interior de uma célula de combustível a hidrogênio. Numa célula de combustível típica, o hidrogênio gasoso diatômico (H2) entra por um lado da célula e o oxigênio gasoso diatômico (O2) entra pelo outro lado.

As moléculas de hidrogênio perdem os seus elétrons e ficam com carga positiva através de um processo chamado oxidação, enquanto as moléculas de oxigênio ganham quatro elétrons e ficam com carga negativa através de um processo chamado redução. Os íons de oxigênio carregados negativamente combinam-se com os íons de hidrogênio carregados positivamente para formar água e liberar energia elétrica.
"O "lado difícil" da célula de combustível é a reação de redução do oxigênio, e não a reação de oxidação do hidrogênio", disse Rauchfuss. "No entanto, descobrimos que novos catalisadores para a redução do oxigênio podem também conduzir a novos meios químicos para a oxidação do hidrogênio".
Rauchfuss e Heiden investigaram recentemente uma geração relativamente nova de catalisadores de hidrogenação de transferência para utilização como hidretos metálicos não convencionais para redução de oxigênio.
Estes pesquisadores focaram na reatividade oxidativa dos catalisadores de hidrogenação de transferência à base de irídio numa solução homogênea não aquosa. Eles verificaram que o complexo de irídio afeta tanto a oxidação de álcoois como a redução de oxigênio.
"A maioria dos compostos reage com hidrogênio ou oxigênio, mas este catalisador reage com ambos", disse Heiden. "Reage com o hidrogênio para formar um hidreto e depois reage com o oxigênio para formar a água; e o faz em um cartucho homogêneo não-aquoso. Os novos catalisadores podem levar ao eventual desenvolvimento de células de combustível de hidrogênio mais eficientes, reduzindo substancialmente o seu custo", disse Heiden.
A solução é não poluir a água
No centro da crise da água está a constatação de que ela não está se esgotando - a quantidade de água que temos na Terra sempre foi a mesma. O que acontece é que estamos a poluindo e, em alguns locais, ela já não está mais disponível. Esta é uma das consequências da degradação dos ecossistemas (florestas e zonas úmidas, por exemplo), que fazem parte do ciclo da água, filtrando e também armazenando este recurso vital, deixando-o limpo e em quantidades suficientes.

Por consequência, temos que parar a poluição da água e multiplicar a quantidade de vegetação, protegendo os ecossistemas existentes.
Além disso, há uma grande necessidade de aprender a administrar a água e utilizá-la de forma consciente. Colocando em números, a produção de um quilo de carne bovina pode consumir entre 500 e 20 mil litros de água, dependendo do país e da proveniência da carne. Segundo dados da ONU, a indústria têxtil é responsável por 20% da água poluída do mundo; por exemplo, a produção de duas calças jeans requer entre 2 e 3 mil litros de água, de acordo com um estudo realizado na Universidade Politécnica de Madrid.